Trong hóa học, độ tan là khái niệm cơ bản và quan trọng nhằm thể hiện khả năng tan của một chất. Để củng cố lại kiến thức quan trọng này bài viết dưới đây chúng ta sẽ cùng nhau tìm hiểu độ tan là gì, công thức và bảng tính tan các chất chi tiết!
Độ tan là gì?
Độ tan là số gam mà chất được hòa tan trong 100g dung môi (thường là nước), tạo nên được dung dịch bão hòa tại điều kiện nhiệt độ cho trước. Nói một cách dễ hiểu thì độ tan chính là đại lượng đặc trưng cho khả năng hòa tan của một chất vào dung môi nhằm tạo nên được dung dịch đồng nhất.

Ví dụ: Một chất có độ tan là 20% trong nước, có nghĩa là trong 100g dung dịch, có 20g là chất tan, 80g còn lại là nước.
Độ hòa tan của một chất được phụ thuộc chủ yếu vào tính chất vật lý, tính chất hóa học của chất tan và dung môi.
So sánh độ tan trong nước của muối, axit, bazơ
Sau đây là bảng so sánh độ tan của muối, axit và bazơ:
| Axit | Bazơ | Muối |
| Hầu hết axit đều có thể tan được trong nước. Trừ axit silixic (H2SiO3) | Phần lớn bazơ không tan trong nước, ngoại trừ NaOH, Ba(OH)2, KOH,… và Ca(OH)2 ít tan | – Các muối Na, K, muối nitrat (-NO3) đều tan trong nước.
– Đa số muối sunfat và muối clorua đều tan. – Muối cacbonat đa phần sẽ không tan. |
Công thức tính độ tan
Công thức tính độ tan xác định được mức độ hòa tan của một chất trong dung môi cụ thể. Điều này đặc biệt quan trọng trong việc hiểu tính chất hòa tan của chất, sự tương tác giữa chất và dung môi để từ đó có thể ứng dụng được trong các lĩnh vực khác nhau như: Hóa học, dược phẩm, công nghệ,…
Công thức chuẩn để tính độ tan S như sau:
S = (mct : mdm) x 100%
Trong đó:
- S là độ tan
- mct là khối lượng chất tan
- mdm chính là khối lượng của dung môi.
Trường hợp dung môi dùng để đo lường là nước thì đơn vị của độ tan là g/100g nước. Với chất cụ thể và 100g nước cho trước, độ tan S sẽ cho thấy:
- S > 10g/100g nước: Là chất dễ tan
- S < 1g/100g nước: Đây là chất ít tan
- S < 0.01g/100g nước: Đây là chất không tan.
Những chất dễ tan sẽ có độ tan càng lớn và ngược lại, vì thế dựa vào công thức chuẩn trên ở điều kiện nhiệt độ xác định, người dùng sẽ tìm được mối quan hệ giữa độ tan S với nồng độ % dung dịch bão hòa (C).
C = (100 x S)/(100 + S).
Yếu tố tác động tới độ tan của chất
Các yếu tố tác động tới độ tan của một chất sẽ bao gồm:
Nhiệt độ
Nhiệt độ là yếu tố quan trọng nhất làm ảnh hưởng đến độ tan của chất. Chất rắn tỏa nhiệt nếu như nhiệt độ tăng thì độ tan của chất rắn sẽ giảm, nguyên nhân là vì nhiệt độ tăng sẽ làm giảm sức đẩy giữa phân tử chất tan và phân tử dung môi.

Ngược lại với những chất rắn thu nhiệt thì độ tan sẽ tăng theo nhiệt độ. Nhiệt độ tăng khiến cho năng lượng phá vỡ cấu trúc tinh thể giảm, vì thế làm giảm cường độ tương tác giữa các phân tử chất rắn, dung môi, giúp tăng độ tan.
Xem thêm: 0, 1 độ c bằng bao nhiêu độ f? Cách đổi độ c sang độ f
Áp suất (đối với chất khí)
Áp suất cũng tác động đến độ tan của chất khí, điều này được thể hiện rõ ở định luật Henry. Lượng khí hòa tan sẽ tỉ lệ thuận với áp suất trên mặt chất lỏng. Áp suất tăng khiến số lượng phân tử khí tác động lên bề mặt chất lỏng tăng, điều này làm tăng khả năng hòa tan và tăng độ tan của chất khí. Ngược lại, nếu áp suất giảm thì độ tan cũng giảm.
Độ phân cực của dung môi, chất tan
Đây cũng là một trong những yếu tố làm ảnh hưởng đến độ tan, chất tan phân cực có thể dễ dàng tan trong dung môi phân cực, còn các chất ít phân cực sẽ dễ tan trong dung môi hữu cơ kém phân cực.

Điều này xảy ra bởi sự tương tác giữa các phân tử có cùng tính chất phân cực, nhờ đó mà việc hòa tan trở nên dễ dàng hơn.
Dạng thù hình
Dạng thù hình sẽ ảnh hưởng đến độ tan của chất rắn, chất rắn ở dạng vô định hình sẽ có độ tan lớn hơn so với các chất rắn dạng tinh thể. Nguyên nhân là bởi chất rắn dạng vô định hình thường có cấu trúc không bền, dễ bị phá vỡ, hòa tan ở trong dung môi.
Chất rắn dạng tinh thể có cấu trúc ổn định hơn, chúng cũng có xu hướng chuyển về dạng tinh thể với tác dụng làm giảm độ tan.
Hiện tượng hydrat hóa
Hiện tượng hydrat hóa xảy ra khi chất rắn tồn tại ở dạng khan và ngậm nước. Trong đó độ tan của chất rắn dạng khan sẽ lớn hơn chất rắn dạng ngậm nước, điều này xảy ra do nước trong cấu trúc hydrat hóa tạo điều kiện để hòa tan tốt hơn chất rắn.

Hiện tượng đa hình
Chất rắn có thể kết tinh dưới các dạng các tinh thể khác nhau tùy vào từng điều kiện kết tinh. Mỗi dạng kết tinh sẽ có tính chất vật lý và độ tan khác nhau, với dạng kết tinh không bền thường có xu hướng chuyển về dạng kết tinh bền, giúp làm giảm độ tan của chất rắn.
Độ pH
Giá trị pH cũng sẽ tác động đến độ tan của chất, điều chỉnh pH có thể làm tăng độ tan của axit yếu hay chất kiềm yếu. Với chất lưỡng tính nếu như gần giá trị pH đẳng điện thì độ tan có thể giảm.

Chất điện hoạt
Các chất điện hoạt có thể kể đến như xà phòng sẽ tạo ra được các micelle trong dung dịch. Quá trình tạo micelle sẽ làm tăng độ tan của chất khó tan.
Chất điện ly
Các chất điện ly cũng là yếu tố làm giảm đi độ tan của chất tan, nên chú ý hãy pha loãng chất điện ly trước khi hòa với dung dịch.
Các ion cùng tên
Khi nồng độ các ion cùng tên tăng thì cân bằng điện ly của chất tan sẽ chuyển dịch về hướng phân tử ít tan, từ đó làm giảm độ tan của chất. Vì thế, nếu hòa tan nhiều chất ở trong cùng một dung môi với nhau thì nên thực hiện theo thứ tự hòa tan từ chất ít tan sau đó mới đến các chất dễ tan.

Độ tan của chất trong dung môi được phụ thuộc vào nhiều yếu tố như đã kể trên. Việc hiểu, cũng như xác định được những yếu tố này sẽ rất quan trọng để dự đoán, kiểm soát được quá trình hòa tan chất trong hệ thống hóa học để ứng dụng được vào trong các lĩnh vực khác nhau.
Hướng dẫn cách tính độ tan
Để tính độ tan bạn có thể áp dụng một trong 2 cách sau đây:
Đo trực tiếp
Đo trực tiếp hiện là cách được dùng phổ biến nhất hiện nay, theo đó với phương pháp này người ta sẽ hòa tan một lượng chất tan nhất định trong một lượng dung môi tại nhiệt độ xác định.

Tiếp đến khuấy đều dung dịch và để yên nhằm đạt được trạng thái bão hòa. Cuối cùng, xác định khối lượng chất tan hòa tan trong dung dịch bão hòa để có thể tính toán được độ tan.
Đo dựa trên công thức
Phương pháp này sẽ dùng công thức toán học nhằm tính toán được độ tan của một chất. Công thức này thường được xây dựng dựa trên lý thuyết về hóa học vật lý.
Theo đó ta có công thức để tính độ tan của một chất rắn trong nước tại điều kiện nhiệt độ xác định là:
S = m/V
Trong đó:
- S là độ tan của chất rắn ở trong nước (g/100 ml)
- m là khối lượng chất rắn được hòa tan ở trong dung dịch bão hòa (g)
- V là thể tích dung môi (ml)
Bảng tính tan các chất
Sau đây là chi tiết bảng tính tan hóa học của các chất:
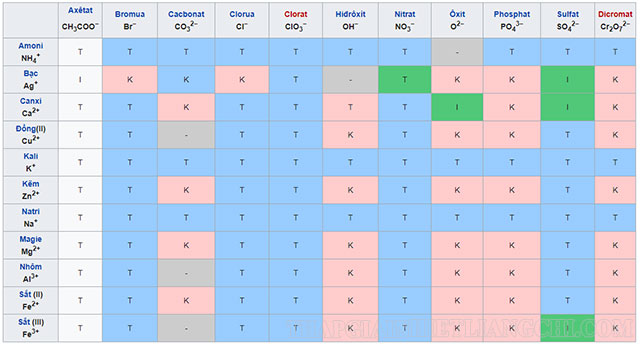
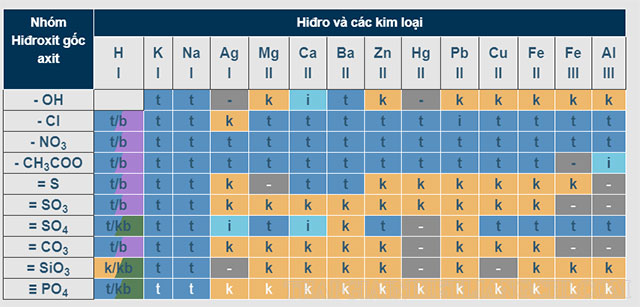
Trong đó:
- T: Là chất dễ tan
- I: Là những chất ít tan
- K: Là các chất không tan
- B: Là chất bay hơi
- (-): Đây là chất không tồn tại hoặc bị nước phân hủy.
Nội dung trên đây đã giúp chúng ta hiểu rõ hơn kiến thức về độ tan là gì, cũng như công thức và thông tin liên quan đến độ tan. Từ đó để giúp bạn đọc có thêm kiến thức hữu ích nhằm bổ trợ tốt hơn cho bộ môn hóa học.



